靶向细胞的科研研究和药物研发避免不了细胞活力的分析和追踪。但依据实验的最终目的和关注参数的不同,细胞活力的体现,检测方法也会不一样。例如细胞增殖检测适用于比较不同细胞株增殖能力,而细胞毒性分析则可以用于探究候选药物是否有细胞毒性等。从分析仪器上来说,现阶段主流的检测平台,如显微镜,流式细胞仪和实时荧光定量pcr仪等都可用于细胞活力的分析,但不同的平台所关注的指标,灵敏度和通量会有所差异,因此需要依据所回答的生物学问题和指标选择合适的检测平台。在上述平台中,酶标仪提供了96、384孔板的高通量细胞活力检测方法,灵敏度上能和经典的[3H]胸腺嘧啶掺入法(Thymidine Incorporation Assay)相媲美,因此成为了主流的科研和工业研发中细胞活力和毒性分析平台。相应的,细胞活力分析也成为了酶标仪的基础应用之一
代谢法细胞活力分析原理和介绍:
代谢法是最常见的细胞增殖检测方法,其主要包括四氮唑还原法(Tetrazolium reduction),如MTT和CCK-8法等,和刃天青还原法(Resazurin Reduction),如alamarBlue法等。这些方法的原理都是基于细胞的代谢能力还原孵育的底物,其产物通常具有光吸收或荧光属性,因此能用酶标仪进行高通量细胞活力分析。
上述方法中,最常见的是MTT法,其属于酶标仪光吸收应用,利用细胞线粒体中的琥珀酸脱氢酶对MTT的还原,形成不溶于水的结晶甲瓒(Formazan)并沉积在细胞中和细胞外。最后使用特定的有机溶剂,如二甲基亚砜(DMSO)等溶解后进行 570 nm处检测。由于MTT本身具有正电荷,因此容易进入细胞,并具有一定的代谢毒性。同时,确切上说,MTT法是检测细胞线粒体的代谢活力。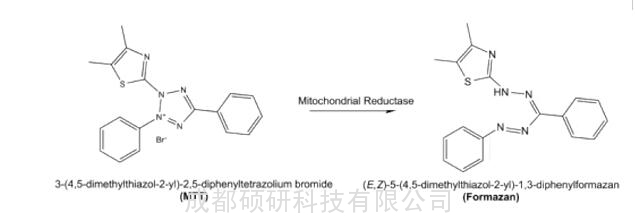
近年来在MTT的基础上一系列类似结构的底物被应用于细胞增殖活力检测中,主要包括MTS, XTT, 和WST等,它们同样属于酶标仪光吸收应用。与MTT不同,这些底物本身具有负电荷,因此不易进入细胞,同时其还原产物可溶于水,因此无需溶解结晶步骤,提升了实验的操作性和稳定性。该系列中,最常见的是基于WST-8的Cell Counting Kit-8(CCK-8法)。相较于仅依赖线粒体脱氢酶的MTT法,CCK-8法基于细胞内多数的脱氢酶,因此其检测活力更为准确,灵敏度更高,同时降低了细胞毒性。由于省去了溶解步骤,CCK-8法支持动力学检测,提高了实验的灵活性。同时因其毒性低,细胞在完成CCK-8法检测后还可以用于后续的其他检测。
上述的代谢法均属于酶标仪光吸收应用,虽然相对经济,但还是会受到光吸收本身的多种限制,尤其是动态范围窄,容易受到具有光吸收特性的试剂和药物干扰等。同时,光吸收法受限于比尔定律中的光径因素,不适用于384或1536孔板等更高通量检测等。因此,基于荧光检测的代谢法也成为了主要的细胞活力检测方法之一,其中常见的是基于刃天青还原的alamarBlue法。
原理上alamarBlue法与MTT和CCK-8法类似,利用增殖中的细胞固有的代谢能力进行还原无色,无荧光的刃天青,所得的红色产物resorufin具有强荧光特性,因此可用支持荧光或光吸收的酶标仪进行检测,提升了检测的灵活性和抗干扰能力[下图]。支持荧光检测的alamarBlue法可具有3-4个动态数量级,具有更宽的检测范围和更高的灵敏度。同时,还原产物可溶于水,低毒,因此和CCK-8一样支持动力学检测和多重检测。然而,alamarBlue法更为稳定,因此非常适合追踪细胞的增殖变化。
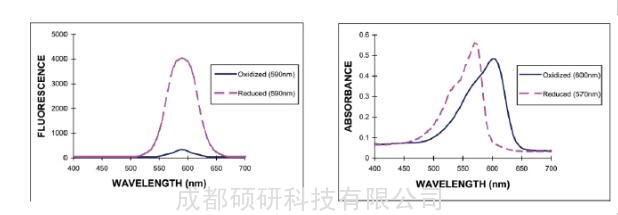 alamarBlue反应前后的荧光(左,530-560 nm 激发)和光吸收变化(右),图片来自于Invitrogen 技术材料
alamarBlue反应前后的荧光(左,530-560 nm 激发)和光吸收变化(右),图片来自于Invitrogen 技术材料
成都硕研科技有限公司代理的美国Bioasssay Systems 细胞活性(荧光)检测试剂盒就是采用的是氧化还原显色剂刃天青,刃天青本身并没有荧光性,但一旦被具有代谢活性的细胞还原,则会转化生成一种强荧光产物(试卤灵)。活细胞很容易还原这种无毒试剂,从而使荧光强度升高,因此可用荧光分光光度计或荧光分析仪方便地检测。非活性细胞没有代谢能力,因此不能还原该显色剂。所以检测中观察到的荧光强度能够准确检测活性细胞的数量。该匀相检测法只需将一种工作试剂加至细胞培养液中,培养后即可测定荧光强度(激发波长= 530 - 570 nm,发射波长= 590 - 620 nm)。
Bioasssay Systems生产的CellQuanti-BlueTM试剂经优化处理,提高了敏感性、可重复性、稳定性。这种基于细胞的匀相检测法可在多孔板中完成。该试剂与所有培养基以及所有液体处理系统都兼容,可在96孔板和384孔板中进行高通量筛选。适用范围包括细胞增殖、细胞毒性和细胞凋亡。
产品特点
安全:非放射性检测(参见3H-胸腺嘧啶核苷掺入法检测)。
敏感且准确:可准确定量低至100个细胞。
高效:采用96孔板和384孔板进行高通量检测,每天可同时处理成千上万的样品。
匀相且简单:只需加入一种试剂的“混合-培养-测量”型检测法。无需冲洗或试剂移取步骤。
高通量:在96孔板和384孔板中观察到的Z’系数通常为0.6-0.9。采用高通量筛选液体处理系统该检测易于自动化。
价格便宜:大包装价格折算后每个孔的检测成本只要几毛钱,比CCK8还便宜
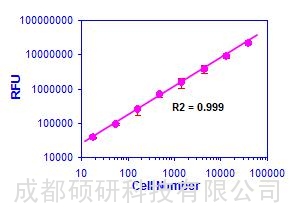
图1. CellQuanti-BlueTM 荧光强度与细胞数量之间的线性关系。 HEK293细胞经连续稀释后,在384孔板中用CellQuanti-BlueTM 试剂进行处理。荧光强度与细胞数量呈线性关系(R2 = 0.999)。根据空白对照品,估计检测限大约为100个细胞。
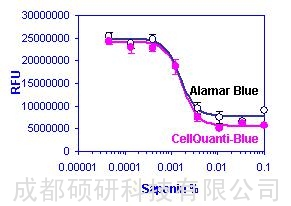
图2. HEK293细胞中皂素的剂量依赖性细胞毒性。每孔(40 mL)中的HEK293 细胞数量为15,000个。用不同浓度的皂素对细胞进行处理。经过一整夜的培养后,加入5mL CellQuanti-BlueTM 试剂(实心圆点)。还加入了AlamarBlue试剂(空心圆点),以供对照。培养3小时后,用Molecular Devices LJL分析仪测量荧光强度。数据表示为均值±标准差(SD)(n = 3)。用CellQuanti-BlueTM和AlamarBlue(信号背景比= 3.3倍)测得的皂素IC50值(信号背景比= 4.8倍)分别是0.0016 wt% 和 0.0017 wt%。
适用范围
细胞增殖: 细胞因子、生长因子和营养成分对活体细胞的影响。
细胞毒性和细胞凋亡: 评价有毒化合物、抗癌抗体、 毒素和环境污染物等。
药物鉴定: 高通量筛选抗癌药物。
试剂盒规格
目录 # | 测试 | 试剂 |
CQBL-05K | 5,000 | 50 mL |
CQBL-10K | 10,000 | 100 mL |
CQBL-HTS | >50,000 | 自定义 |
对照试剂(Cat # CTTX-050):50 mg皂素(需单独订购)。
储存条件:CellQuanti-BlueTM 试剂对光敏感,应在4°C下保存于试剂盒提供的棕色瓶内。对照试剂在-20°C下保存。保质期12个月。
检测步骤:
CellQuanti-BlueTM检测是基于具有代谢活性的细胞能将非荧光试剂转化成荧光产物的原理。对大多数细胞而言,完成这种还原反应需要1至5小时。然后用荧光分析仪定量测定产物的荧光强度。虽然培养基大多含有酚红,但酚红并不会干扰检测结果。技术要点中的所有数据都是在含有酚红的培养基中测得的。
试剂制备:
注:使用前先将试剂放置至室温。
96孔板测定步骤:
1. 在黑色96孔组织培养板中培养细胞(80 mL)。典型的培养基含DMEM、10%胎牛血清和抗生素(青霉素/链霉素、庆大霉素等)、氨基酸和其它营养物。不论是粘附细胞还是悬浮细胞,都可进行检测。每孔的细胞数量可从100至80,000个之间不等。尽管本方案中使用80 mL,但培养体积可从50至150mL之间不等。除待测样品外,还应设定对照孔,对照孔的培养基应不含细胞或细胞已经有毒试剂(如0.1%皂素)处理过。
2. 加入待测化合物和对照品,培养细胞至所需的时间(通常一整夜)。建议一式两份或一式三份进行检测。可将待测化合物和对照品(20 mL)加入到磷酸盐缓冲盐水(PBS)或培养基中。用5 mLPBS(0.1%皂素)溶液方便地配制对照试剂。
3. 将CellQuanti-BlueTM 试剂放置至室温。向每孔中加入10 mL该试剂(每100 mL 细胞培养液)。可根据细胞培养液的体积调整所加试剂的体积。轻敲孔板使细胞与试剂混合,在37°C下培养1至5小时。
4. 用荧光分析仪测量每孔的荧光强度。如果采用的是Molecular Devices LJL分析仪,则应使用若丹明滤光镜(530nm激发滤片、590nm发射滤片和570nm分色镜)。
384孔板测定步骤:
1. 在黑色384孔组织培养板中培养细胞(40 mL)。每孔的细胞数量可从100至20,000之间不等。尽管本方案中使用40 mL,但培养体积可从25至60mL之间不等。除待测样品外,还应设定对照孔,对照孔中的培养基应不含细胞或细胞已经有毒试剂(如0.1%皂素)处理过。
2. 加入待测化合物和对照品,培养细胞至所需的时间。建议一式两份或一式三份进行检测。建议将10 mL体积的待测化合物加入到PBS溶液或培养基中。
3. 将CellQuanti-BlueTM 试剂放置至室温。向每孔中加入5mL该试剂(每50 mL细胞培养液)。轻敲孔板使细胞与试剂混合,在37°C下培养1至5小时。
4. 用荧光分析仪测量每孔的荧光强度。如果采用的是Molecular Devices LJL分析仪,则应使用若丹明滤光镜(530nm激发滤片、590nm发射滤片和570nm分色镜)。
总则
培养时间:培养时间取决于细胞系。部分细胞系的代谢活性很强,因此其所需的培养时间比代谢活性稍弱的细胞系更短。可通过多次读数轻松确定培养时间,如加入CellQuanti-BlueTM 试剂后每30分钟读取一次。一般来讲,培养1至5小时就已足够。当细胞数量很大时,培养时间过长(如 >18小时)可能导致非线性荧光响应。
细胞数量:一般来讲,优化后的 CellQuanti-BlueTM 试剂会随着培养细胞数量的增加表现出大范围的线性荧光响应。建议测定信噪比最高的各孔的细胞数量。最佳细胞数量可根据细胞连续稀释而轻松确定。
对照品:尽管不是必需程序,但可以设定阳性对照品,即有细胞毒性或可促进细胞增殖。皂素是一种有细胞毒性的试剂,可从本公司购买(参见技术要点图2)。每次检测都应使用空白对照品,即不含细胞或所含细胞已经0.1%皂素处理过的培养基。根据空白对照品可以确定背景荧光,数据分析时应扣除背景荧光。
数据分析
对于细胞增殖或细胞毒性的检测,待测化合物的活性可计算为细胞数量的变化百分比,计算方法如下,
活性(%) 或细胞活性 (%) = 100 x (Fcmpd - Fo) / (Fctrl - Fo)
Fcmpd 和 Fctrl 分别是加入和未加入(基质对照)待测化合物时的平均荧光强度。Fo 是空白对照品的平均荧光强度。
对于剂量反应研究,可绘制检测数据与化合物浓度的曲线。也可采用Prism 或其他数据分析工具通过非线性回归分析确定EC50(细胞增殖检测)和IC50(细胞毒性检测)。
参考文献
细胞增殖检测
1. Kreisler M, Christoffers AB, Willershausen B, D'Hoedt B (2003). Low-level 809 nm GaAlAs laser irradiation increases the proliferation rate of human laryngeal carcinoma cells in vitro. Lasers Med Sci. 18(2):100-3.
2. Nordling MM, Glinghammar B, Karlsson PC, de Kok TM, Rafter JJ (2003). Effects on cell proliferation, activator protein-1 and genotoxicity by fecal water from patients with colorectal adenomas. Scand J Gastroenterol. 38(5):549-55.
3. Kipshidze N, Moussa I, Nikolaychik V, Chekanov V, Khanna A, Colombo A, Leon MB, Moses J (2002). Influence of Class I interferons on performance of vascular cells on stent material in vitro. Cardiovasc Radiat Med. 3(2):82-90.
4. Gloeckner H, Jonuleit T, Lemke HD (2001). Monitoring of cell viability and cell growth in a hollow-fiber bioreactor by use of the dye Alamar Blue. J Immunol Methods. 252(1-2):131-8.
细胞毒性检测
5. Nociari MM, Shalev A, Benias P, Russo C (1998). A novel one-step, highly sensitive fluorometric assay to evaluate cell-mediated cytotoxicity. J Immunol Methods. 1998;213(2):157-67.
6. Mikus J, Steverding D (2000). A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye Alamar Blue. Parasitol Int. 48(3):265-9.
7. Byth HA, Mchunu BI, Dubery IA, Bornman L (2001). Assessment of a simple, non-toxic Alamar blue cell survival assay to monitor tomato cell viability. Phytochem Anal. 12(5):340-6.
8. Lee JK, Kim DB, Kim JI, Kim PY (2000). In vitro cytotoxicity tests on cultured human skin fibroblasts to predict skin irritation potential of surfactants. Toxicol In Vitro. 14(4):345-9.
评价抗体的细胞毒性作用
9. Gazzano-Santoro H, Ralph P, Ryskamp TC, Chen AB, Mukku VR (1997). A non-radioactive complement-dependent cytotoxicity assay for anti-CD20 monoclonal antibody. J Immunol Methods. 202(2):163-71.
体外化学敏感性
10. Sawabe Y, Yamagishi H, Yamaguchi N, Yamamura Y, Oka T (1996). In vitro chemosensitivity of human pancreatic cancer cell lines. Int J Pancreatol. 20(3):185-90.
筛选细胞毒性化合物
11. Mikus J, Steverding D (2000). A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye Alamar Blue. Parasitol Int. 48(3):265-9.
12. Breinholt V, Larsen JC (1998). Detection of weak estrogenic flavonoids using a recombinant yeast strain and a modified MCF7 cell proliferation assay. Chem Res Toxicol. 11(6):622-9.
技术要点
CellQuanti-BlueTM测试盒经特殊优化处理,且配比恰当,对于细胞增殖和细胞毒性的检测,这是一种敏感、方便且稳健的检测手段。该试剂盒的主要特点如下:
安全:非放射性检测(参见3H-胸腺嘧啶核苷掺入法检测)。
敏感且准确:可准确定量低至100个细胞。
高效:采用96孔板和384孔板高通量检测每天可同时处理成千上万的样品。
匀相且简单:只需加入一种试剂的“混合-培养-测量”型检测法。无需冲洗或试剂移取步骤。
稳健且适合高通量筛选:在96孔板和384孔板中观察到的Z’系数通常为0.6-0.9。采用高通量筛选液体处理系统该检测易于自动化。